来源:广州宏武材料科技有限公司 专业生产纳米碳材料 发布时间:2018-01-17浏览量:次
同素异形体,是指由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质。同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。
碳元素广泛存在于茫茫苍穹的宇宙间和浩瀚无垠的地球上,当今世界,碳质材料和碳基复合材料在日常生活和工业领域得到广泛的应用,以碳为主要构成元素的有机化学及其发展为塑料、橡胶和纤维等三大合成材料奠定了基础,而这些合成材料又为人们创造了一个绚丽多彩的新世界。
碳的同素异形体有金刚石、石墨、富勒烯、碳纳米管、石墨烯和不定型碳等,它们的物理性质差别很大,但在氧气里燃烧后的产物都是二氧化碳。它们的不同性质是由微观结构的不同所决定的。如下图:
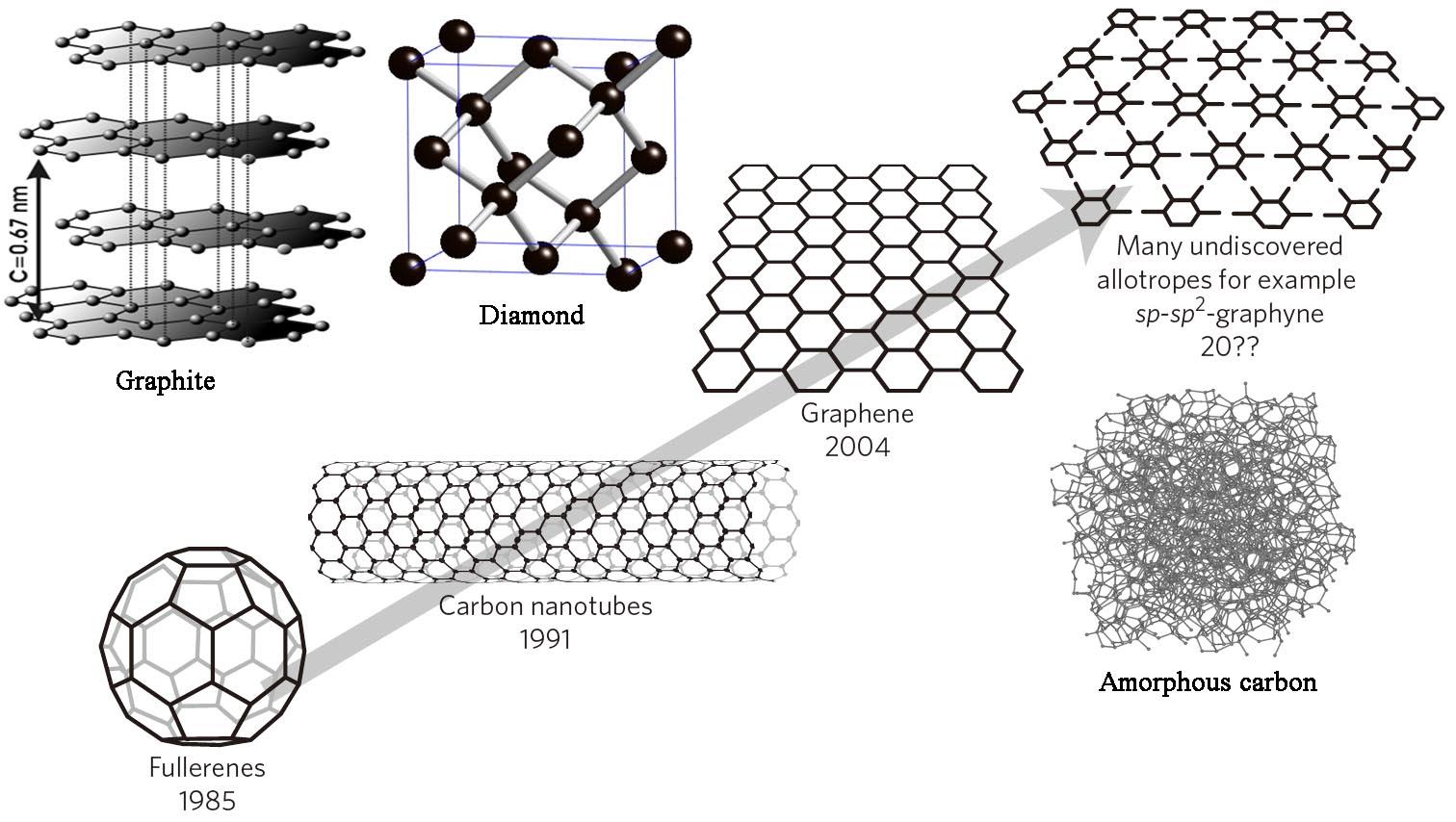
这些碳的同素异形体的导电性能从导体、半导体、半金属,一直延伸到绝缘体。如:sp3杂化形成的金刚石是绝缘体;sp2杂化形成的石墨、石墨烯是良导体;区于sp3和sp2之间的,如碳纳米管和富勒烯是半导体/金属型和半导体。
1、纳米金刚石的晶体结构
金刚石是典型的原子晶体,在这种晶体中的基本结构粒子是碳原子.每个碳原子都以sp3杂化轨道与四个碳原子形成共价单键,构成正四面体.每个碳原子位于正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连续的、坚固的骨架结构.价电子都参与了共价键的形成,使得晶体中没有自由电子,所以金刚石是自然界中最坚硬的固体,熔点高达3 550 ℃,并且不导电.。
2、纳米石墨的晶体结构
石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形蜂巢状的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质.而平面结构的层与层之间则依靠分子间作用力(范德华力)结合起来,形成石墨晶体由于层间的分子间作用力弱,因此石墨晶体的层与层之间容易滑动,工业上用石墨作固体润滑剂.
3、富勒烯的晶体结构
以C60为例,C60是单纯由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。其相对分子质量约为720。杂化方式介于sp2杂化和sp3杂化之间,整个表面形成一个大的共轭体系,具有较高的反应活性。